穩定性試驗研究作為藥品在研發、臨床、上市及上市后質量研究的重要內容,主要目的是考察藥品在溫度、濕度、光照等因素的影響下質量隨時間變化的趨勢,為藥品的生產工藝、制劑處方、包裝材料、貯藏條件和有效期/復檢期的確定提供支持性信息。通過試驗建立藥品的有效期,以保障用藥的安全有效。
同時,穩定性試驗研究作為藥品質量控制研究的基本內容,與藥品標準的建立緊密相關,且具有階段性特點,貫穿藥品研究與開發的全生命周期。

在工藝開發階段,小試產品的穩定性探索可以為后續中試產品的穩定性研究做預判;在新藥注冊申報時,需要完成穩定性試驗(長期穩定性試驗、臨床使用穩定性試驗、反復凍融穩定性、運輸穩定性等),以指導在臨床試驗階段試驗用藥的存儲及使用;藥品上市后,雖然產品沒有發生變化,但每年也必須要做持續穩定性考察。
生物制品穩定性試驗一般包括長期穩定性試驗、加速穩定性試驗、強制試驗(也稱影響因素試驗,屬于穩定性試驗的探索)。長期穩定性試驗一般是在推薦的貯藏條件下進行的,其可以作為制定產品儲存條件和有效期的重要依據;加速穩定性試驗一般是在長期與強制試驗條件之間進行的,其目的在于評估運輸和存儲過程中條件的短期偏離對產品的影響(包括生物降解或物理變化等);強制試驗一般是在更惡劣、更極端的環境下進行,其目的在于評估產品的降解途徑、破壞程度,也被用來評價產品雜質(降解產物)分析方法的有效性。
選擇經驗豐富的合作伙伴進行穩定性檢測可有效保證生物制品順利推進。
Yaohai Bio-Service:穩定性試驗研究服務概覽
耀海生物搭建了成熟的質量控制服務平臺,檢測場地為1500㎡的GMP級實驗室,憑借豐富的實驗室品質管理經驗及分析檢測能力,累計開發了50+ 檢測技術方法,成功服務了近百個生物制品檢測項目,能夠滿足生物制品(重組蛋白、多肽類、質粒產品等)及菌種放行檢測要求,支持生物藥開發生命周期的分析與質控需求。同時,在檢測標準方面,依據中國、美國、歐盟等全球主流制藥市場的法規要求和行業共識,建立了全面、高標準的檢測體系,目前實驗室體系已通過中國GMP、歐盟QP審計。
依托良好的質量管理體系、齊全的質量分析研究設備和豐富的藥物研究及申報經驗基礎,公司致力于為客戶提供一站式穩定性研究及申報資料撰寫服務。穩定性試驗研究服務項目主要包括穩定性方案/報告設計、分析方法轉移/驗證、樣品存儲、樣品檢測、NDA/MAA申報資料撰寫等。

同時,也可根據客戶項目實際需求,提供系列化定制檢測服務,滿足客戶不同類型項目的檢測需求。
定制化服務內容包括但不限于
項目專屬穩定性考察方案/報告、分析方法轉移/驗證、樣品運輸/存儲、樣品檢測、電子數據備份/災難恢復、合規流程管理(OOS/OOT/異常/偏差)
穩定性試驗研究及考察的相關法規依據
ICH,2003.02.06,Q1A~Q1F Stability
NMPA,2015.02,化學藥物(原料藥和制劑)穩定性研究技術指導原則
NMPA ,2015.04,生物制品穩定性研究技術指導原則(試行)
中國藥典2020版 9001原料藥物與制劑穩定性試驗指導原則
USP,現行版
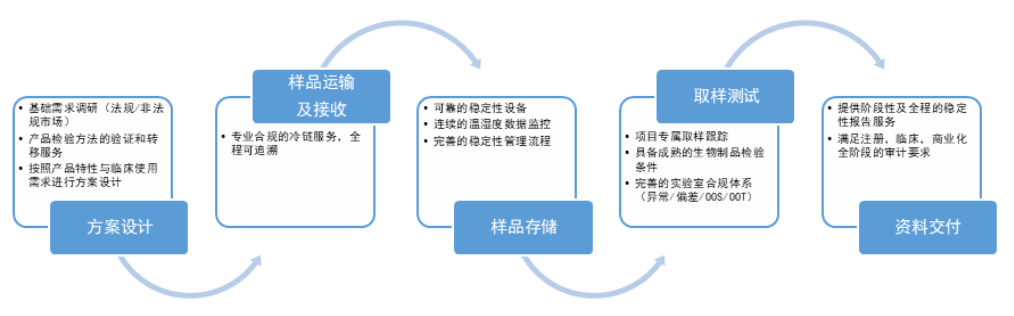
穩定性試驗研究項目承接服務流程
服務優勢與特色
01先進的實驗設施和完善的資質
實驗室通過生物安全實驗室二級備案,滿足無菌、微生物限度等檢測需求;
實驗室體系已通過中國GMP、歐盟QP審計,可滿足各合規要求。
匹配豐富的檢測儀器設備配置、技術先進(UPS電源系統、服務器數據備份系統(可實現災難恢復)、testo溫濕度在線管理和實時監控報警系統)。
02專業穩定的服務團隊
QC檢測服務團隊擁有出眾的專業技能及豐富的生物制品檢測經驗,攻關能力強,能夠切實為有難度的項目提供有效解決方案。
注冊團隊核心成員擁有十余年藥品注冊和項目管理經驗,具備多模塊專業知識,及豐富的專業運作經驗。
03豐富的實戰項目經驗
已成功服務近百個獨立的穩定性考察項目,積累大量客戶合作經驗,與國內多家知名藥企保持長期合作關系,值得信賴。
04成熟的生物制品穩定性研究方案
一站式生物制品穩定性研究方案,涵蓋產品分析與評估、穩定性研究計劃制定、環境模擬與條件設置、定期檢測與數據分析、風險評估與預測及持續監控改進等,確保整體服務方案符合相關法規要求。
05高效的項目服務體系
項目管理經驗豐富,項目經理一對一服務,高效協同,加快項目交付周期。
實驗室關鍵設備設施展示