在重組蛋白等生物制品的小試工藝放大至生產規模時,耀海生物會評估以下變化可能導致的工藝放大風險:①培養基滅菌方式改變;②增加一級或多級種子罐,傳代次數改變;③培養過程中傳質、剪切作用不同;④補料方式存在差異(如泵的準確性);⑤適用于不同處理批量的離心和破碎設備不同;⑥大批量衍生的配液/儲液特殊需求。以上變量可能對目標物質的產量、收率、穩定性造成影響。
因此,在小試工藝打通后,我們建議至少1批中試放大生產進行工藝的調整,目的是保證小試工藝至生產階段的成功轉移。
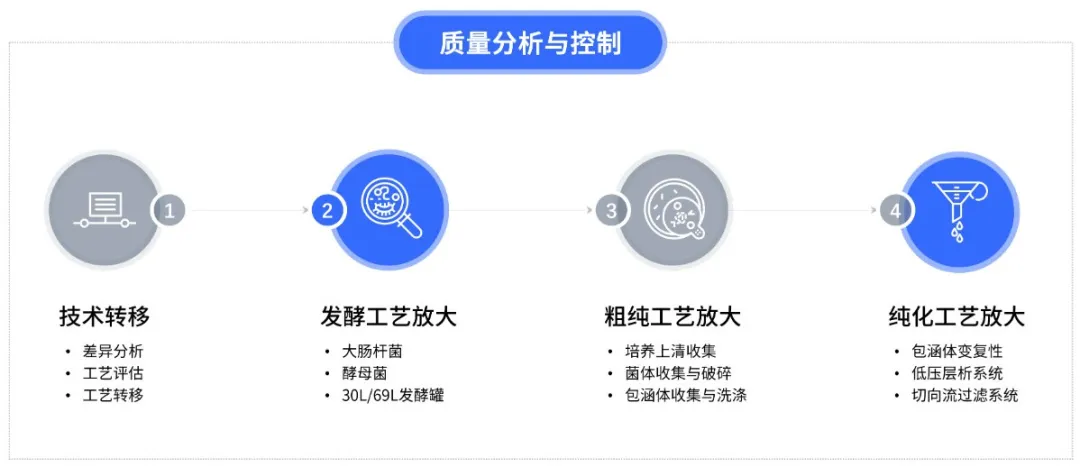
基于十余年微生物表達體系重組蛋白/質粒DNA生產及服務經驗,耀海生物搭建了成熟完善的GMP-like級中試放大服務平臺。截至目前,公司已成功服務了多個I-III期臨床項目。耀海生物GMP-like級中試放大平臺可用于小試工藝的優化,降低工藝放大的風險。制備的中試樣品也可用于分析方法開發、穩定性預實驗、制劑處方開發和制劑工藝開發試驗等。
耀海生物GMP-like級中試放大平臺擁有30L/69L發酵體系,并匹配不同規格的層析系統。耀海生物GMP-like級中試放大平臺可滿足30L/69L發酵規模下的工藝評估、工藝重現、工藝優化、中試樣品生產等需求。我們能夠高質量完成重組蛋白原液工藝的放大、優化和轉移,向客戶交付完整的中試放大報告,高效率推動CDMO項目的開發進程。
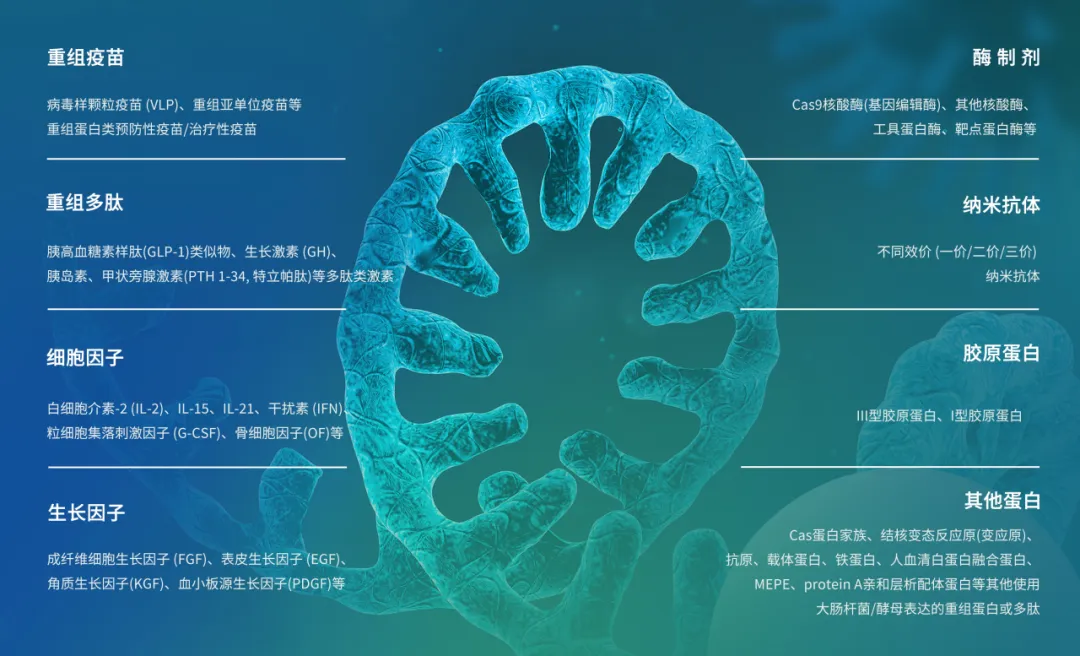
耀海生物中試放大平臺可服務的重組蛋白制品
服務詳情
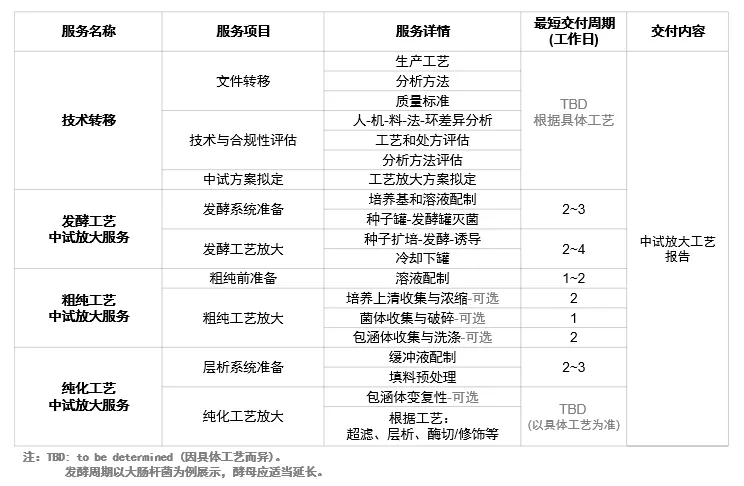
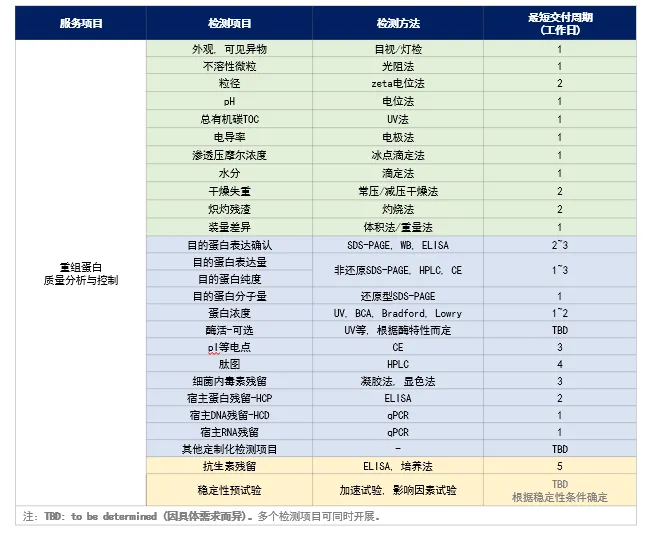
重組蛋白質量分析與控制
中試放大服務特色
1.完善的中試放大服務平臺
耀海生物GMP-Like級中試原液車間,涵蓋30L/69L發酵罐,匹配對應規模的離心、高壓均質和低壓層析設備,高效完成小試工藝放大。
2.多品種工藝放大經驗
耀海生物團隊全流程貫徹QbD理念,已成功實現多品類重組蛋白制品工藝放大與工藝轉移,覆蓋病毒樣顆粒疫苗(VLP)、重組亞單位疫苗、納米抗體、抗體片段、胰島素、細胞因子、生長因子、酶制劑、膠原蛋白等。
3.質量合規保障平臺支撐
專業的QC團隊協助完成樣品的檢測,有效保證質量標準;
QA與注冊團隊協助評估工藝過程與質量標準的合規性,如宿主來源、無動物源、抗生素類型、毒性或致敏性、純度、工藝過程殘留等,全流程符合注冊申報需求。
4.一站式CDMO服務平臺支撐
基于超十年的多品種生產及服務經驗,耀海團隊貫徹全流程產業化理念,能夠保證小試工藝、中試工藝穩定放大至生產水平。