注:本文不構成任何投資意見和建議,以官方/公司公告為準;本文僅作醫療健康相關藥物介紹,非治療方案推薦(若涉及),不代表耀海生物立場。任何文章轉載需得到授權。
在真核生物中,poly(A)尾巴幾乎存在于每個mRNA上。3'端poly(A)尾巴對于mRNA的翻譯來說發揮著至關重要的作用,它可以保護mRNA不被降解,增加mRNA的穩定性,提高翻譯效率。
那大家知道poly(A)尾是如何促進翻譯并控制mRNA的穩定性的嗎?今天菌菌分享一篇在《Nature Reviews Molecular Cell Biology》(1區,IF:113.915)上發表的綜述文章:Roles of mRNA poly(A) tails in regulation of eukaryotic gene expression。該文章詳細闡述了poly(A)尾在基因表達調控中的作用,包括poly(A)尾在翻譯和控制mRNA穩定性中的作用,以及poly(A)尾長與翻譯效率的關系。
Poly(A)尾促進mRNA翻譯
Poly(A)尾有助于mRNA的翻譯狀態和穩定性,作為細胞質中基因表達的主要調節因子發揮作用。具體來說,poly(A)尾可以與mRNA 5'端上的7-甲基鳥苷(7-methylguanosine,m7 G)帽協同作用以刺激翻譯。哺乳動物的poly(A)尾平均長度約為200nt,其在酵母中平均約70nt。研究發現,具有非常短的poly(A)尾巴的mRNA通常不能正常翻譯。當mRNA的poly(A)尾巴多腺苷酸化,翻譯被激活,這表明mRNA翻譯受到poly(A)尾長的影響。

圖1 真核細胞質中PABPC結構域
細胞質多聚腺苷酸結合蛋白(polyadenylate-binding protein,PABPC)對于poly(A) 尾在介導轉錄物翻譯和穩定性中的作用是必要和充分的。PABPC在真核生物中高度保守,具有四個N端RNA識別基序(RNA recognition motif,RRM)結構域,它們以納摩爾親和力結合poly(A) 尾(圖1)。
RRM和RRM2對poly(A)的親和力和特異性高于RRM3和RRM4。在細胞質中,PABPC與poly(A)尾結合需要約12個腺苷酸(通過RRM1和RRM2),但實際上需要30個腺苷酸。長的尾巴可以結合更多的PABPC,例如90nt的poly(A)尾巴可以結合三個PABPC分子[1]。然而,近期的數據表明[2]細胞中的PABPC濃度可能是有限的,并且細胞中的穩態poly(A)尾長不一定與PABPC的量相關。
Poly(A)尾促進翻譯機制:“閉環”模型
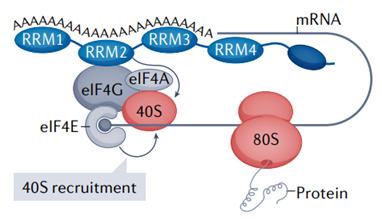
圖2 mRNA“閉環”模型
現在很清楚,mRNA 3'端的poly(A)尾可以影響5'端的翻譯起始[3]。mRNA的3′端poly(A)尾如何刺激5′端的翻譯起始?真核翻譯起始因子4E(eukaryotic translation initiation factor 4E,eIF4E)識別5?帽并與另一種翻譯起始因子eIF4G相互作用,后者又與PABPC結合。因此,mRNAs可以形成一個“閉環”,使5′帽和3′ poly(A)尾之間的直接物理通信成為可能(圖2)。eIF4G與PABPC的相互作用穩定了eIF4E-cap相互作用,同樣,PABPC與poly(A) RNA的相互作用穩定了它與eIF4G的相互作用。PABPC還通過增強其ATP酶和解旋酶活性來刺激另一種翻譯起始因子eIF4A。
總之,cap-eIF4E-eIF4G-PABPC-poly(A) 復合物被認為會刺激小(40S) 核糖體亞基的募集(圖 2)。40S與起始密碼子上的大(60S)核糖體亞基組裝形成可翻譯的80S核糖體。
Poly(A)尾有助于mRNA的穩定性
在酵母細胞中,細胞質mRNA主要的降解途徑是通過縮短poly(A)尾巴啟動的,此過程稱為去腺苷酸化(deadenylation)。
Poly(A)尾部如何賦予mRNA穩定性?一個假設是PABPC通過阻止外切酶進入來保護mRNA的3'端。與假設一致,通過轉錄脈沖追蹤和體外重組在內的一系列實驗表明,poly(A)尾縮短或去腺苷酸化需要在釋放PABPC之前,mRNA衰變才可以進行。將過量的poly(A) RNA添加到體外降解系統中會隔離與PABPC的結合,從而將poly(A)尾暴露在RNA上并導致其不穩定。相反,在體外測定中添加過量的PABPC會抑制去腺苷酸化[4]。
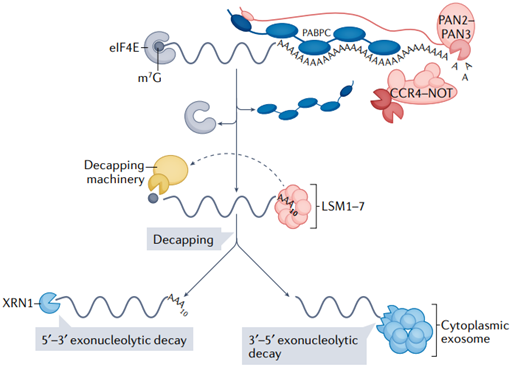
圖3 真核生物mRNA去腺苷酸化和衰變
在mRNA被降解之前,它的poly(A)尾會被PAN2-PAN3和/或CCR4-NOT去腺苷酸化復合物去除。這會釋放細胞質多聚腺苷酸結合蛋白(PABPC),并可能削弱真核翻譯起始因子4E(eIF4E)與5?帽的結合。
然后,脫帽酶可以結合并移除5?帽。LSM1-7復合物可以與oligo(A)尾或3?尿嘧啶尾結合,促進5?端脫帽。脫帽后mRNA在5'-3'方向被外切核糖核酸酶1(XRN1)降解或在3'-5'方向被細胞質外泌體復合物降解(圖3)。通過eIF4E-eIF4G-PABPC在mRNA “閉環”中5'和3'末端之間的物理相互作用為poly(A)尾如何影響脫帽提供了可能的解釋。這些相互作用穩定了cap上的eIF4E[5],并可以防止脫帽酶的結合。因此,poly(A)尾可能通過PABPC抑制帽和脫帽酶之間的結合來維持mRNA的穩定性。
Poly(A)尾長影響翻譯效率
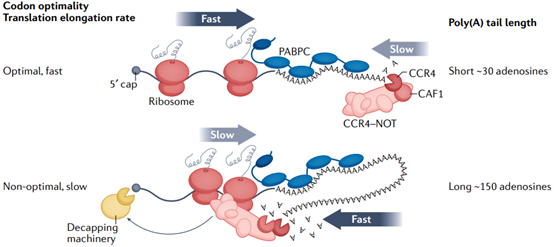
圖4 poly(A)尾長影響翻譯效率
Poly(A)尾長度、翻譯效率和mRNA穩定性之間并不是簡單的線性關系。Poly(A)尾長度并非恒定不變,poly(A)尾中也含有非A的核苷酸組分。
CCR4-NOT可以通過檢測含有空A和E位點的核糖體來感知翻譯延伸率,從而招募脫帽機制。多項實驗表明,32nt以上的poly(A)尾在翻譯效率上就等同于150nt長度的poly(A)尾,但當poly(A)尾長度不足16nt時,mRNA無法翻譯。Poly(A)尾可以穩定mRNA(允許它們翻譯),并且通常需要約30nt的尾長來賦予穩定性。
這個長度正好對應于PABPC與poly(A)尾結合需要的腺苷數。這些發現具有許多重要意義。
首先,高度翻譯的mRNA具有約30個腺苷的短poly(A)尾,該長度只能容納單個PABPC,這表明一個PABPC足以促進有效翻譯。
其次,之前假設長的poly(A)尾與增加的mRNA穩定性相關。然而,這些新數據表明,poly(A)尾巴縮短到約30nt的mRNA也可以是穩定的。事實上,穩態poly(A)尾長和mRNA半衰期的相關性差或呈負相關,并且PABPC對mRNA 的占有率與穩態poly(A)尾長不相關。
第三,這些發現提供了翻譯效率和去腺苷酸化之間的密切聯系,支持了翻譯效率與mRNA穩定性直接相關的觀點(圖4)。
總結
菌菌總結一下文獻中的觀點:
一、結合poly(A)尾巴的PABPC跟翻譯起始因子中的eIF4G相互作用,使得mRNA形成“閉環”結構,有助于募集40S翻譯起始復合物到mRNA上,與5'末端帽子結構協同作用,共同刺激翻譯起始。
二、Poly(A)尾通過PABPC抑制帽和脫帽酶之間的結合來維持mRNA的穩定性。
三、Poly(A)尾長度、翻譯效率和mRNA穩定性之間并不是簡單的線性關系。高度翻譯的mRNA具有約30個腺苷的短poly(A)尾,該長度只能容納單個PABPC,這表明一個PABPC足以促進有效翻譯。
Poly(A)尾作為mRNA翻譯和穩定性的中心調節劑,將隨著mRNA的治療手段和疫苗的興起成為該領域的研究熱潮。因此理解poly(A)尾在基因表達調控中的作用、以及poly(A)尾長與翻譯效率的關系,有助于提升對poly(A)尾生物學功能的完全理解。由此觀之,poly(A)尾的故事還遠未結束。
參考文獻:
[1] SCH FER I B, YAMASHITA M, SCHULLER J M, et al. Molecular Basis for poly(A) RNP Architecture and Recognition by the Pan2-Pan3 Deadenylase [J]. Cell, 2019, 177(6): 1619-31.e21.
[2] XIANG K, BARTEL D P. The molecular basis of coupling between poly(A)-tail length and translational efficiency [J]. 2021, 10.
[3] VICENS Q, KIEFT J S, RISSLAND O S. Revisiting the Closed-Loop Model and the Nature of mRNA 5'-3' Communication [J]. Molecular cell, 2018, 72(5): 805-12.
[4] VISWANATHAN P, OHN T, CHIANG Y C, et al. Mouse CAF1 can function as a processive deadenylase/3'-5'-exonuclease in vitro but in yeast the deadenylase function of CAF1 is not required for mRNA poly(A) removal [J]. The Journal of biological chemistry, 2004, 279(23): 23988-95.
[5] BORMAN A M, MICHEL Y M, KEAN K M. Biochemical characterisation of cap-poly(A) synergy in rabbit reticulocyte lysates: the eIF4G-PABP interaction increases the functional affinity of eIF4E for the capped mRNA 5'-end [J]. Nucleic acids research, 2000, 28(21): 4068-75.