注:內容來源于藥融圈

中國目前是世界第二大醫藥市場,也是亞洲一開始的市場之一。隨著全球生命科學的不斷發展,復雜生物制劑(抗體/融合蛋白/胰島素)、疫苗、基因治療類以及部分小分子藥物將會有突破性發展,預灌封注射器將是這些藥物的遞送載體。早在2002年,艾伯維開發的全球全人源單抗新藥阿達木單抗(商品名:修美樂,英文商品名Humira)上市后,全球生物制藥領域開啟了高速發展的20年,榮登藥王多年。
藥融云數據, www.pharnexcloud.com顯示:修美樂原研銷售金額可達206.96億美元。本品即預灌封注射器(Prefilled Syringe,簡稱PFS)這一種藥物遞送系統有效使用案例之一。
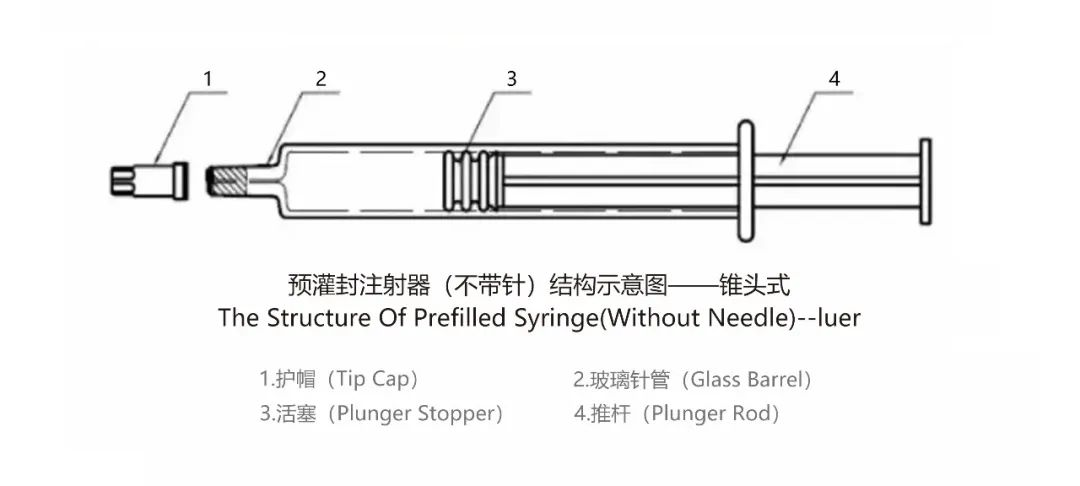
由于對用藥安全性(降低被銳器損傷風險)、便利性(使用時直接注射,省時省力,能夠減輕醫護人員工作量)、降低交叉污染風險、提高劑量準確性的需求提高,預灌封注射器(PFS)藥物遞送系統正在快速興起。當前而言,其他超級重磅新藥使用預灌封注射器(PFS)藥物遞送系統的有:來自默沙東的4/9價HPV疫苗佳達修、 輝瑞的13價肺炎球菌多糖結合疫苗沛兒、拜耳/再生元的阿柏西普、諾華/羅氏的雷珠單抗、羅氏的托珠單抗雅美羅、諾華/羅氏基因泰克的奧馬珠單抗等等。
從2001年到2020年,預灌封注射器全球總銷量的年復合增長率 (CAGR) 超過 6.9%。榮格數據顯示:全球預灌裝注射器市場在2019年價值達47億美元,預計到2026年將達到105.7億美元。


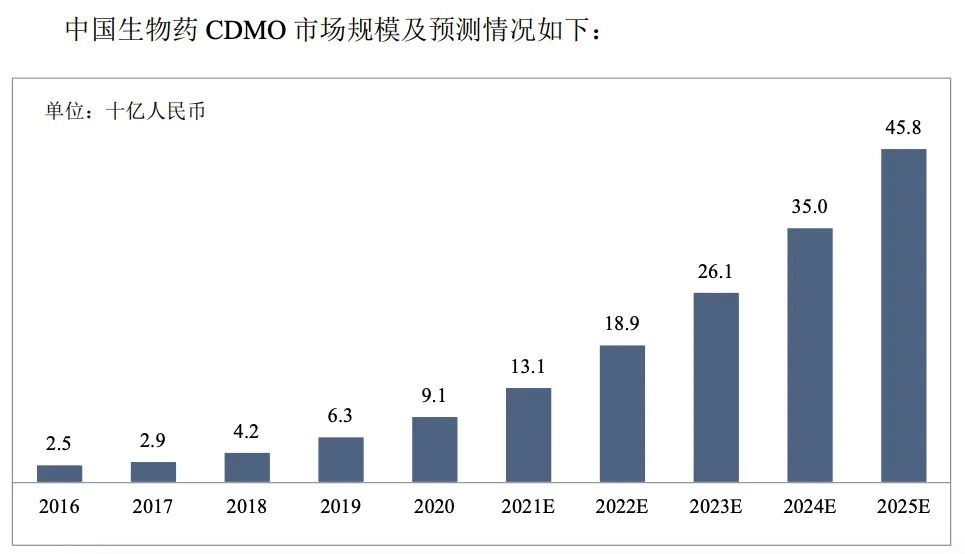
新藥開發是一項復雜的系統工程,風險極高,可謂“九死一生”。制藥界此前流傳著“雙十定律”的說法,即開發一款新藥平均需要10年、耗資10億美元,許多企業為了降低風險,節約成本,會選擇CDMO企業為其提供工藝研發及生產服務。同時,MAH制度下產、研、銷分離,助力CDMO企業獲得更多新藥開發與生產的合作機會。沙利文數據預測:未來國內生物藥CDMO市場將保持快速增長,預計到2025年將達到458億元人民幣。2020到2025年的年復合增長率為38.1%。

目前,根據生物藥等研發工藝和生產步驟的特殊性,與客戶進行戰略合作,能為生物制藥企業提供CDMO定制化服務組合的企業在國內市場仍然稀缺。使用具有支持服務經驗的制藥服務合作伙伴可以減少開發和供應風險,降低成本,并加快產品上市速度。
無菌制劑灌裝作為整個生物藥GMP生產的后面環節,需要專業知識、良好的設計與嚴格的規定以保證成品的質量。高標準的無菌保證體系貫穿著這一非常復雜的連續式生產過程。整個過程涉及到原液(Drug Substance,DS)化凍和混勻、除菌過濾、洗瓶、灌裝加塞、凍干、軋蓋、燈檢、包裝等多重工序,每一個工序都會直接影響的成品質量。
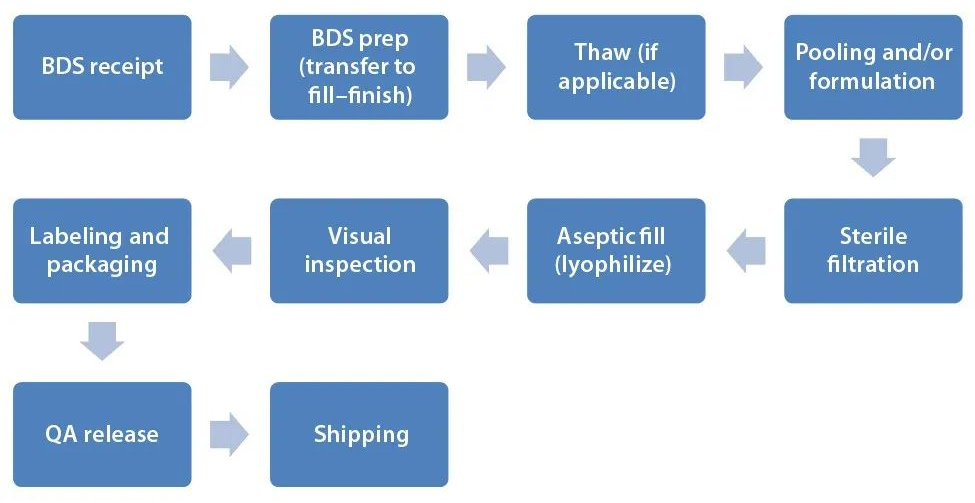
▲灌裝流程示意圖片
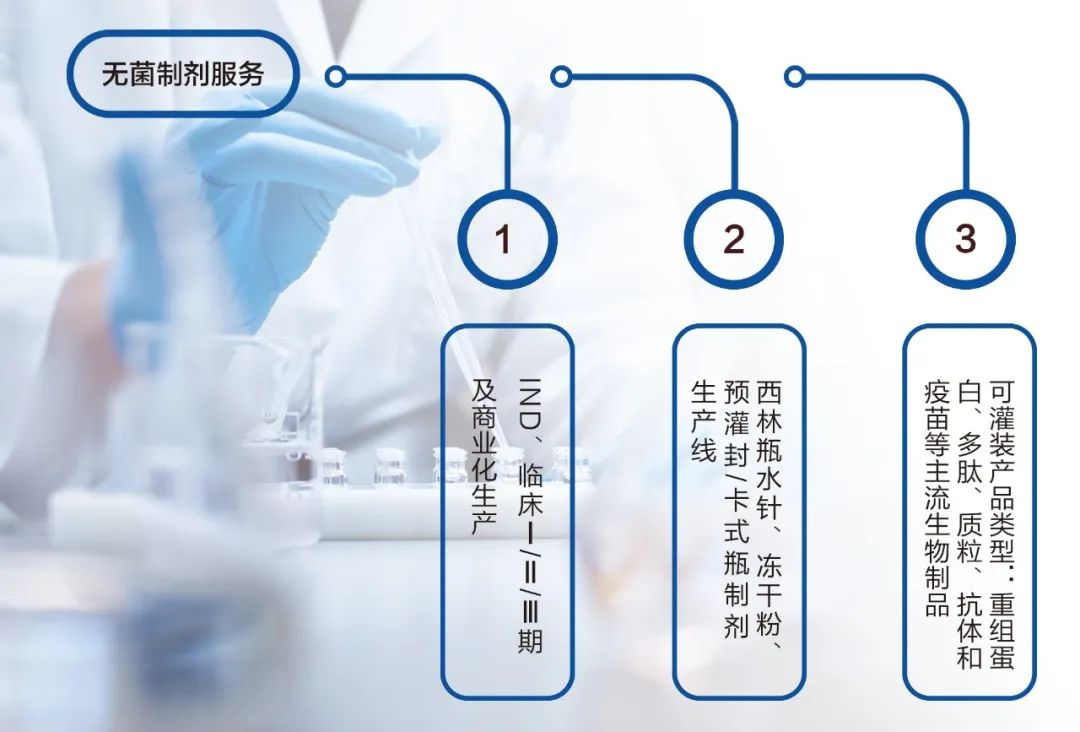
藥融圈獲悉:2022年3月,這家潛力CDMO公司的大分子藥物研發及生產服務平臺項目投產使用,在原生物制品西林瓶水針、凍干粉針制劑生產線的基礎上,新增建設了一條無菌預灌封制劑生產線,進一步擴充了耀海生物在制劑灌裝生產方面的整體產能。
據悉,截止目前:耀海生物可提供年產量預灌封/卡式瓶800萬支,西林瓶水針1000萬支,西林瓶凍干粉500萬支的制劑灌裝服務。具體的生產規格為1ml和3ml。

本次產線擴增,新建設的無菌預灌封制劑生產線,可為客戶提供預灌封注射器、卡式瓶無菌制劑的灌裝生產。全自動灌裝線按照GMP等相關法律法規要求進行生產。整條生產線采用自動灌裝自動壓塞的灌封系統,灌裝設備采用真空加塞,藥液灌裝可用普通灌裝、充氮灌裝及真空灌裝,以滿足不同性質藥液的生產。藥液灌裝工作均在無菌環境下進行,可大限度地減少污染風險,提供穩定的無菌保障。
耀海生物在生物藥無菌制劑領域擁有豐富的GMP生產經驗,嚴格的生產過程,完善的質量管理及良好的無菌保障體系,可保障合規、高質高效的完成無菌制劑生產工作。具體而言,公司可為客戶提供臨床樣品生產至商業化生產的西林瓶與預灌封生產的優質服務。

高質量的生物藥產能布局,是候選產品可量產化成功的保障。耀海生物目前擁有符合GMP要求的5條微生物發酵和純化的成熟生產線,可提供10L-100L、200L、500L、1000L及2000L等規模的原液CDMO服務,發酵總規模達7500L。同時,可提供年產能1000萬支西林瓶水針、500萬支凍干粉針、800萬支預灌封制劑的CDMO服務。
迎生物制劑革新,耀海生物致力于多層次持續提升CDMO服務矩陣能力,打造全球標準,助推新藥進程,成就健康生活。服務于生物醫藥產業蓬勃發展的初心不改,耀海生物將乘生物醫藥大勢,未來可期。