撰文:劉傳敏 陳海棠
受全球新冠疫情的影響,生物制藥行業(yè)備受關(guān)注,在MAH制度下越來(lái)越多的企業(yè)進(jìn)入生物制藥CMO行業(yè),但在委托生產(chǎn)過(guò)程如何保證藥品質(zhì)量是推進(jìn)MAH制度的關(guān)鍵問(wèn)題,也是CMO企業(yè)極力想要解決的問(wèn)題。
根據(jù)調(diào)研顯示“研發(fā)企業(yè)產(chǎn)品專利保護(hù)或關(guān)鍵物料掌控能力”、“現(xiàn)有CMO企業(yè)知識(shí)產(chǎn)權(quán)(商業(yè)秘密)保護(hù)力度”和“現(xiàn)有CMO企業(yè)生產(chǎn)質(zhì)量體系”是研發(fā)企業(yè)考慮是否選擇委托生產(chǎn)的重要因素。
基于上述的法規(guī)和委托雙方訴求,本文將提出作為生物制藥CMO企業(yè)進(jìn)行委托生產(chǎn)的管理要求,為MAH制度推行和CMO企業(yè)委托生產(chǎn)管理提供參考。
上市許可持有人制度(MAH)概述
上市許可持有人制度(簡(jiǎn)稱“MAH”)是指將上市許可與生產(chǎn)許可分離的管理模式。在這種機(jī)制下,上市許可持有人可以將產(chǎn)品委托給不同的生產(chǎn)商,藥品上市許可持有人依法對(duì)藥品研制、生產(chǎn)、經(jīng)營(yíng)、使用全過(guò)程中藥品的安全性、有效性和質(zhì)量可控性負(fù)責(zé)。

2019年8月26日修訂的《中華人民共和國(guó)藥品管理法》規(guī)定,MAH于12月1日起正式在全國(guó)推廣實(shí)施。在MAH制度下CMO企業(yè)作為提供藥品生產(chǎn)外包服務(wù)活動(dòng)的單位依法應(yīng)承擔(dān)相應(yīng)責(zé)任。
MAH制度下委托生產(chǎn)法規(guī)要求
根據(jù)《中華人民共和國(guó)藥品管理法》規(guī)定,藥品上市許可持有人的法定代表人、主要負(fù)責(zé)人對(duì)藥品質(zhì)量全面負(fù)責(zé)。藥品上市許可持有人應(yīng)當(dāng)對(duì)受托藥品生產(chǎn)企業(yè)、藥品經(jīng)營(yíng)企業(yè)的質(zhì)量管理體系進(jìn)行定期審核,監(jiān)督其持續(xù)具備質(zhì)量保證和控制能力。藥品上市許可持有人委托藥品生產(chǎn)企業(yè)生產(chǎn)的,應(yīng)當(dāng)委托符合條件的藥品生產(chǎn)企業(yè)。藥品上市許可持有人和受托生產(chǎn)企業(yè)應(yīng)當(dāng)簽訂委托協(xié)議和質(zhì)量協(xié)議,并嚴(yán)格履行協(xié)議約定的義務(wù)。
2020年9月27日國(guó)家藥監(jiān)局發(fā)布了藥品委托生產(chǎn)質(zhì)量協(xié)議指南(2020年版)和藥品委托生產(chǎn)質(zhì)量協(xié)議模板(2020年版)用于指導(dǎo)、監(jiān)督藥品上市許可持有人和受托生產(chǎn)企業(yè)履行藥品質(zhì)量保證義務(wù),自發(fā)布之日起施行。
受托企業(yè)需具備的條件
具備保障藥品安全性、有效性和質(zhì)量可控性的質(zhì)量管理、風(fēng)險(xiǎn)防控和責(zé)任賠償?shù)饶芰Γ男邢嚓P(guān)義務(wù)承擔(dān)相應(yīng)責(zé)任,取得相應(yīng)生產(chǎn)范圍的藥品生產(chǎn)許可證并在效期內(nèi),廠房設(shè)施設(shè)備、人員、體系等符合藥品生產(chǎn)管理規(guī)范。

在進(jìn)行體系建立時(shí),在合規(guī)的基礎(chǔ)上還需要考慮上市許可持有人對(duì)產(chǎn)品“把控力”的靈活要求。除此外,還應(yīng)在內(nèi)部考慮建立保密相關(guān)措施,加強(qiáng)知識(shí)產(chǎn)權(quán)(商業(yè)秘密)保護(hù)力度。
委托生產(chǎn)流程
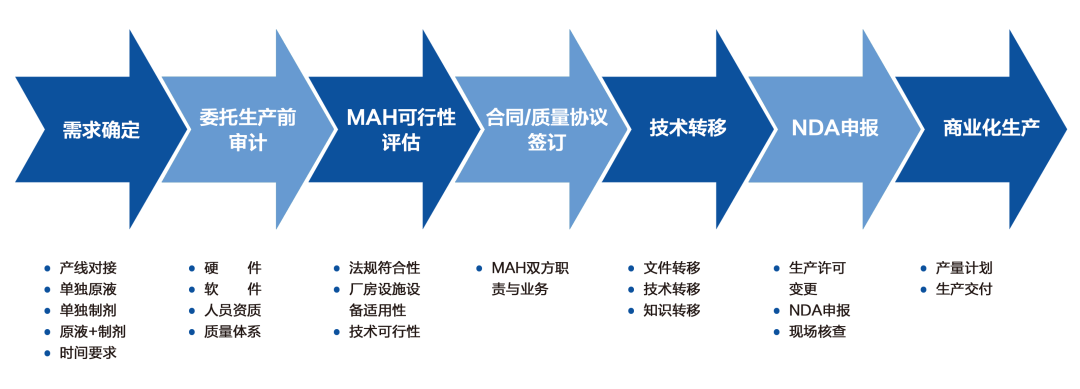
我國(guó)相關(guān)的藥品監(jiān)管法律與其他國(guó)家不同,醫(yī)藥產(chǎn)業(yè)基礎(chǔ)也不同,不同的公司對(duì)于MAH制度下的委托生產(chǎn)也有不同的管理要求和流程,以下是以某藥企MAH委托生產(chǎn)管理為例制定的流程圖。
01
需求確定后,藥品上市許可持有人應(yīng)對(duì)受托藥品生產(chǎn)企業(yè)條件及能力、倉(cāng)儲(chǔ)條件、公用系統(tǒng)、生產(chǎn)技術(shù)水平、質(zhì)量保證進(jìn)行質(zhì)量審計(jì),對(duì)受托方的質(zhì)量保證能力和風(fēng)險(xiǎn)管理能力進(jìn)行體系情況、綜合評(píng)價(jià)等。評(píng)價(jià)受托方是否有能力接受委托生產(chǎn)評(píng)估,包括法規(guī)符合性評(píng)估、廠房設(shè)施設(shè)備及生產(chǎn)條件、檢驗(yàn)并保證藥品的質(zhì)量,并出具書面審計(jì)方案和報(bào)告,審計(jì)材料作為相關(guān)證明文件進(jìn)行保存。
02
質(zhì)量審計(jì)結(jié)束后,委托雙方可進(jìn)行技術(shù)交流確定工藝技術(shù)方面的可執(zhí)行性,,藥品上市許可持有人基于前期的溝通交流與審計(jì)情況綜合對(duì)受托藥企進(jìn)行MAH委托生產(chǎn)可行性評(píng)估 , 確定后續(xù)人員、硬件、體系、軟件等方面的需求,便于后續(xù)委托生產(chǎn)協(xié)議與質(zhì)量協(xié)議的簽訂,規(guī)定藥品委托生產(chǎn)范圍,確定雙方責(zé)任和義務(wù)。
03
協(xié)議簽訂后,雙方可根據(jù)協(xié)議制定技術(shù)轉(zhuǎn)移方案,明確溝通機(jī)制、技術(shù)轉(zhuǎn)移具體內(nèi)容、方法和可接受標(biāo)準(zhǔn)。技術(shù)轉(zhuǎn)移方案批準(zhǔn)后,按照方案要求進(jìn)行技術(shù)轉(zhuǎn)移相關(guān)工作。涉及到菌種轉(zhuǎn)移的還需要關(guān)注菌種轉(zhuǎn)移全程監(jiān)控相關(guān)工作,確保菌種轉(zhuǎn)移過(guò)程中轉(zhuǎn)運(yùn)符合要求,數(shù)據(jù)真實(shí)可靠,并提供菌種庫(kù) COA與無(wú)噬菌體污染的檢測(cè)報(bào)告 。
04
技術(shù)轉(zhuǎn)移完成并評(píng)價(jià)技術(shù)轉(zhuǎn)移合格后,可進(jìn)行NDA申報(bào)等工作,現(xiàn)場(chǎng)核查評(píng)審?fù)ㄟ^(guò)后,可進(jìn)行后續(xù)的商業(yè)化生產(chǎn),在上述工作執(zhí)行過(guò)程中,上市許可持有人應(yīng)對(duì)受托企業(yè)進(jìn)行監(jiān)管。商業(yè)化生產(chǎn)前,委托雙方還應(yīng)對(duì)后續(xù)溝通范圍與機(jī)制、運(yùn)輸方式、生產(chǎn)計(jì)劃下達(dá)方式進(jìn)行討論,受托方進(jìn)行藥品出廠放行,上市許可持有人進(jìn)行上市放行。上市許可持有人應(yīng)在商業(yè)化階段生產(chǎn)中對(duì)受托藥品生產(chǎn)企業(yè)的質(zhì)量管理體系進(jìn)行定期審核,監(jiān)督其持續(xù)具備質(zhì)量保證和控制能力。
總結(jié):
我國(guó)藥品生產(chǎn)企業(yè)普遍存在著“多、小、散、亂”的現(xiàn)象,當(dāng)前我國(guó)藥品安全事故呈現(xiàn)多發(fā)趨勢(shì),且大多數(shù)都是人為因素。如編造生產(chǎn)和檢驗(yàn)記錄、擅自更改生產(chǎn)工藝、蒙騙和賄賂檢查人員等行為屢見(jiàn)不鮮,不僅破壞了正常市場(chǎng)秩序,也損害了社會(huì)公眾的健康利益;CMO 與 CDMO行業(yè)雖然目前發(fā)展迅速,除去具備國(guó)際經(jīng)驗(yàn)的著名CMO公司外,多數(shù)國(guó)內(nèi)CMO公司的技術(shù)、人員和管理經(jīng)驗(yàn)都有待發(fā)展 。通過(guò)委托生產(chǎn),研發(fā)企業(yè)可以將資金集中投入于研發(fā)領(lǐng)域,釋放研發(fā)企業(yè)的創(chuàng)造力,同時(shí)減少生產(chǎn)領(lǐng)域的重復(fù)建設(shè),進(jìn)一步促進(jìn)社會(huì)分工與資源的合理配置。
隨著新冠疫情的影響,基于MAH制度優(yōu)化國(guó)內(nèi)制藥資源配置、降低研發(fā)資金門檻等多種優(yōu)勢(shì),眾多研發(fā)企業(yè)躍躍欲試。MAH制度正式實(shí)施后,由研發(fā)型MAH主導(dǎo)的委托生產(chǎn)剛剛起步,委托方與受托方的權(quán)責(zé)利益劃分目前僅憑雙方經(jīng)驗(yàn)確定。建議生物制藥CMO企業(yè)在進(jìn)行項(xiàng)目與質(zhì)量體系搭建時(shí),合規(guī)的基礎(chǔ)上還應(yīng)考慮藥品上市許可持有人對(duì)產(chǎn)品“把控力”的靈活要求和知識(shí)產(chǎn)權(quán)保護(hù)需求,讓想委托生產(chǎn)的研發(fā)企業(yè)真正放心地去委托生產(chǎn),推動(dòng)MAH 制度落地,提升生產(chǎn)效率,節(jié)約生產(chǎn)成本,同時(shí)保證生產(chǎn)質(zhì)量,實(shí)現(xiàn)委托生產(chǎn)雙贏。