01、概述
近年來,全球醫藥行業的競爭日趨激烈,制藥產業鏈中的分工日益細化,醫藥行業的專業化外包已成為制藥企業的重要戰略選擇。隨著醫藥外包服務機構專業化程度的不斷提高,醫藥外包服務的內容逐漸涵蓋了從疾病目標研究、藥物化合物篩選、臨床試驗服務、工藝研發、規模化生產直至市場銷售的各環節。
02、CRO、CMO、CDMO
2.1 CRO
隨著新藥研發成本的日益增長,許多跨國制藥公司開始剝離研發中的非核心部分,逐漸催生出了一個龐大的全球研發外包市場——合同研究組織(CRO)。CRO企業即合同定制研發機構,是指通過合同形式為制藥企業和研發機構在藥物研發過程中提供專業化服務的機構。CRO提供包括新藥產品開發、臨床前試驗及臨床試驗、數據管理、新藥申請等多種技術服務,幾乎涵蓋了新藥研發的整個過程。
其基本目的在于協助制藥企業進行科學或醫學研究,主要提供的服務包括新藥發現、安全性評價研究服務、藥代動力學、藥理毒理學等臨床前研究及臨床數據管理、新藥注冊申請等。
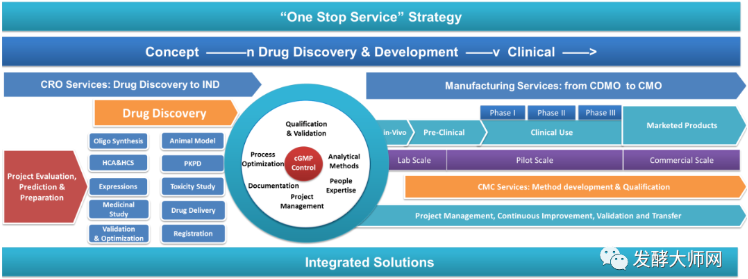
2.2 CMO
CMO(ContractIlanufacturing0rganization)即合同定制生產機構,是指以合同定制形式為制藥企業提供中間體、原料藥、制劑的生產以及包裝等服務的企業。起源于20世紀80年代后期,由于當時全球經濟后退,許多制藥企業在強大的競爭壓力下開始將非核心或不具優勢的生產和銷售業務進行外包,從而降低企業自身運營成本,增強企業競爭力。
傳統的CMO企業僅提供以委托企業提供的技術路線為基礎的代工生產服務。隨著制藥公司對成本控制和效率提升的要求不斷提高,制藥企業希望CMO 企業能夠承擔更多工藝研發、改進的創新性服務職能,CDMO企業應運而生。
2.3 CDMO
CDMO (ContractDevelopmentandManufacturingOrganization)企業即合同定制研發生產機構,除了提供傳統CMO的生產服務之外,更強調對生產工藝的研發和創新。CDMO 企業往往在新藥臨床階段的早期即與客戶開展深度合作,為客戶提供制藥工藝的開發、設計及優化服務,并在此基礎上提供從公斤級到噸級的定制生產服務。CDMO 企業利用自身技術優勢及生產能力,承接了制藥企業的工藝開發和生產職能,從而使制藥企業可以更專注于藥物的研發。
03、三者在藥品設計與研發方面的差異
| 醫藥外包服務機構 | 在藥品設計與研發方面提供的服務 | 服務具體內容 |
| CRO | 藥物開發相關的 | 臨床前 CRO 服務包括新藥發現、安全性評價研究服務、藥代動力學、藥理毒理學、動物模型的構建等:臨床 CRO 服務主要針對臨床試驗階段的研究提供服務,涵蓋臨床 I-IV 期技術服務、臨床數據管理和統計分析、新藥注冊申報等 |
| 科學或醫學研究 | ||
| CMO | 不涉及實質性研發工作 | 根據客戶提供的生產工藝直接進行代工生產,不涉及生產技術或工藝的實質性研發 |
| CDMO | 藥物生產工藝的設計、研發 | 根據客戶對目標化合物的技術與質量要求,開展工藝設計、工藝優化等服務,并在此基礎上提供定制生產服務 |
04、CDMO服務與銷售產品之間的關系
銷售商品是公司CDMO服務成果的交付形態。藥物研發是一項高風險、 高投入、長周期的系統性工程。制藥企業客戶為了降低藥品研發成本,提高生產效率,將制藥工藝研發和生產委托于公司定制開展。公司接受跨國制藥企業委托為其提供的制藥工藝研發和藥物生產的服務過程即為CDMO服務。公司服務內容一般包括工藝設計、工藝放大、化學結構或組分確認,質量及穩定性研究、雜質研究、定制生產等多種研發和生產內容。工藝開發和生產過程完成后,公司將服務形成的中間體或原料藥等商品交付給客戶完成全部服務過程。具體而言, 發行人提供的CDMO服務與銷售產品之間關系如下:
(1)CDMO服務是商品形成的業務過程
公司為客戶提供的 CDMO 服務的主要目標是按照客戶要求成功研發出具備商業化生產可行性的醫藥中間體或原料藥等產品。CDMO服務是產品得以形成的過程。
(2)CDMO服務是滿足客戶定制需求的必要條件
不同于大多數通用產品取得訂單便可以組織實施生產,醫藥定制產品是專業性程度強、定制化程度高的特殊產品。公司在開展定制研發和定制生產過程中,必須時刻知悉定制客戶的特定需求通過反復多次的技術交流,確定產品的各項技術細節。制藥企業客戶期望通過委托合作取得的定制化商品,只有通過CDMO的詳細服務過程,才能得以實現,CDMO 服務過程是定制化商品形成的必要條件。
(3)終端客戶通過質量審計等合作程序參與公司提供的 CDMO 服務
由于醫藥行業的特殊性,醫藥行業的定制研發生產與普通合同委托有大的差別。終端客戶將藥物研發生產環節委托給公司定制開展,對藥品及其中間體的安全、有效和質量都極其關注,僅依據交付的商品無法對藥品生產過程進行全面有效判斷。
(4)公司 CDMO 服務內容及成果交付形態與同行業可比上市公司的 CDMO 服務內容及成果交付形態基本一致

憑借多年在微生物表達體系領域的實踐經驗積累,耀海生物堅持以“創新研發、平臺構建、產能提升、合規保障”等多維度的不斷發展,目前公司已搭建成熟的多肽、蛋白質藥物一站式CRDMO服務平臺,業務涵蓋“重組蛋白/多肽、核酸藥物、納米抗體、新型重組疫苗和重組質粒”等方向,成功交付兩百余個項目,貫穿早期研究、IND新藥臨床申報、臨床樣品GMP生產和商業化生產的全生命周期。
不論在技術研發創新還是生產產能布局,耀海生物在國內均位于領先。通過創新的工藝技術平臺、科學規范的服務體系及豐富的項目實踐經驗,能夠為廣大合作伙伴提供端到端的、一站式CRDMO整體解決方案。
1. 豐富的項目經驗
? 經過多年深耕,公司已經搭建了行業內領先的一站式CRO/CDMO/MAH開放式服務平臺。截止目前,公司已成功交付兩百余個項目,包括3個Ⅲ期臨床項目,4個Ⅱ期臨床項目,多個IND及Ⅰ期臨床項目,其中7個中美雙報,2個澳洲注冊項目,服務項目涉及多種類型主流生物藥物及廣泛的適應癥,滿足全球多地注冊申報,積累了豐富的項目經驗和服務能力。
2. 端到端、一站式的CRDMO服務能力
? 公司堅持以創新驅動技術、技術驅動服務的戰略定位,以專業純粹、高效優質的一站式CRDMO服務平臺,致力于為客戶提供從基因工程菌構建、菌種庫建立、小試工藝開發優化、中試工藝放大生產、IND申報和臨床樣品制備、質量標準建立、分析方法開發驗證、合規化生產(GMP)、質量管理體系建立、注冊申報等全生命周期的CRDMO服務。
3. 專業穩定的項目團隊保障
? 公司擁有經驗豐富的CRDMO執行團隊,匹配專業人才梯隊,具備深厚的生物制品全生命周期服務經驗,能夠快速響應、靈活應對不同項目類型,高效協同助推項目委托服務,確保所有項目高質量及時交付。
4. 全面的產能保障(高產能&高靈活性)
? 公司在泰州建有符合GMP的規模化生產服務基地,配備多條完整的上下游產線,可提供50L-100L、200L、500L、1000L及2000L等規模的原液CDMO服務,發酵總規模達7500L;兩條制劑產線,覆蓋西林瓶水針/凍干、預充針/卡式瓶等劑型,年產量超1000萬支。高質量的產能布局,能夠為廣大生物制藥企業提供更廣維度的全流程服務。
5. 卓越的合規服務保障體系
? 公司已全面構建專業化、標準化、規范化的服務保障體系,確保全生命周期符合新版藥典及GMP等相關指導原則。
質量管理是耀海生物的生命線。公司可提供全方位的質量管理服務,堅持以顧客滿意為目標,建立“質量為本、完善合規、簡單高效、團結協作”的質量方針,致力于提供符合FDA、EMA、NMPA的IND和臨床階段樣品制備,及滿足NMPA商業化階段的藥品生產全方位質量管理服務。
6. 以客戶為中心的項目管理服務
? 公司聚焦以客戶為中心的優質CRDMO服務,與客戶建立密切合作,匹配專業的項目管理團隊一對一服務,嚴格把控項目重點里程碑及項目風險的識別和管理,全方位滿足客戶需求。同時高度重視客戶知識產權保護,建立嚴苛、合理的保密機制和保密措施,確保客戶項目信息和知識產權安全。